日本**疗器械命名法(JMDN)代码确定了器械的分类和注册途径。
装置被分为一般类I,指定控制类II,控制类II,指定高度控制类III,高度控制类III,或高度控制类IV。
MHLW允许在日本没有地点的制造商通过外国特别审批系统(FSAS)注册他们自己的II、III和IV类设备。
此注册路径允许您以自己的名义注册您的设备,并承担营销授权持有者(MAH)的一些责任。
国内制造商和国外制造商的制造机构注册
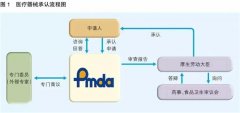
PMD法案为制造商定义了一种新的注册制度。
注册制度要求国内制造商向当地政府注册其制造企业,并取得制造商注册(MR)。
另一方面,外国制造商必须向PMDA注册其制造企业,并获得外国制造商注册(FMR)证书。
MR和FMR是申请**疗器械注册的一项要求,需要在备案前获得。质量管理体系符合日本条例169
日本的PMD法案(《确保药品、**疗器械、再生和细胞治疗产品、基因治疗产品和化妆品的质量有效性和安全性法案》)于2014年由厚生劳动省(MHLW)颁布。
此外,它为在日本销售其设备的**疗器械制造商定义了质量管理体系(QMS)要求。
介绍了国内外生产厂家的具体要求,并与ISO 13485:2003进行了质量管理体系的协调。
日本已经将ISO 13485作为其质量管理体系要求的基础。
PMD法案为**疗设备制造商引进了一种更加协调的质量管理方法。
然而,部长条例**69号包含了额外的质量管理体系要求,你必须满足,以完全符合。
通过调整ISO 13485和条例#169之间的一些差距,具有ISO 13485认证的制造商将发现遵守条例#169是相当直接的。
成功完成QMS合格评定后,MAH或制造商由PMDA或RCB颁发QMS合格证书(Kijun Tekigoshou)。
合格证书有效期为五年,并包括注册的产品名称、产品集团(Seihingun)和生产设施。
根据PMD法案,未来的合格评定集中于在PMDA或RCB注册的同一产品组的设备,而不是生产工厂。
联系我时,请说是在得易搜分类信息网看到的,谢谢!










 未上传身份证认证
未上传身份证认证  未上传营业执照认证
未上传营业执照认证