/美国长期以来占据着**疗器械世界第一大消费市场的地位,美国FDA同样代表着世界上最高的**疗器械监管能力和技术水平。因疫情和欧盟法规的变动影响,国内**疗器械企业对于出口美国的需求日益增加。
美国市场对中低风险的**疗器械进行上市后监管,少数I类产品和几乎全部II类产品需要510(k)许可才能上市。**疗器械制造商在提交510k申请并获得许可后,即可在美国市场上市销售。
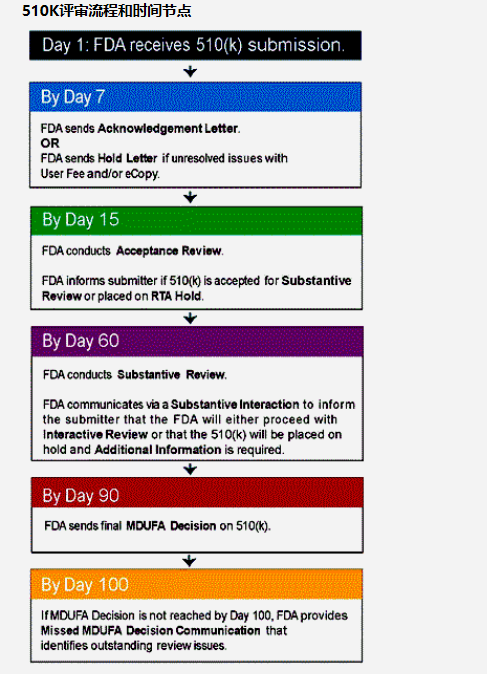
FDA510K是什么?
也被称为上市前通告(Pre-market Notification)。将申请510K的器械和⼀个
已经合法⼊市的器械(⽐对器械-Predicate Device)进⾏对⽐,得出具有相同
的使⽤⽬的,以及具有相同的技术特性;或者具有相同的使⽤⽬的,以及具有
不同的技术特性但是不会引起新的安全和有效性⽅⾯的问题,以及证明其安全
性和有效性同对⽐器械⼀致。也就是说,需要证明实质等同性( Substantial
Equivalence )
怎么判定申请510K的产品跟比对器械实质等同(SE)?
-具有相同的预期用途;
-具有相同的技术特征;
或
-具有相同的预期用途;
-具有不同的技术特征,但是能够证明器械和比对器械一样安全有效;
*SE的宣称并不意味着申请器械和比对器械需要完全一致。通常情况下FDA会
对不一致的技术特征进行审查,通过科学方法和性能数据判定这些特征不会引
起安全有效性的问题。如,临床&非临床性能检测,包括工程性性能测试,灭
菌,电磁兼容,软件验证,生物相容性等。
谁需要提交510K?
-在美国销售**疗器械的境内制造商;
-在美国引入**疗器械的研发设计者;
-重大变更标签或是对器械有较大变更的再包装者或是重新贴标者;
这里指的重大标签变更包括说明书的变更,比如预期用途发生变化,警告添加或删
除,禁忌症添加或删除等;一些可能导致器械条件发生变化的操作,如灭菌。
但是,大多数重新包装或重新标签者无需提交510K申请。
-境外制造者/出口商
联系我时,请说是在得易搜分类信息网看到的,谢谢!









 未上传身份证认证
未上传身份证认证  未上传营业执照认证
未上传营业执照认证